| 「特医食品」研制生产、注册、临床试验与药品比较 | 您所在的位置:网站首页 › ich gcp适用于动物临床试验么 › 「特医食品」研制生产、注册、临床试验与药品比较 |
「特医食品」研制生产、注册、临床试验与药品比较
|
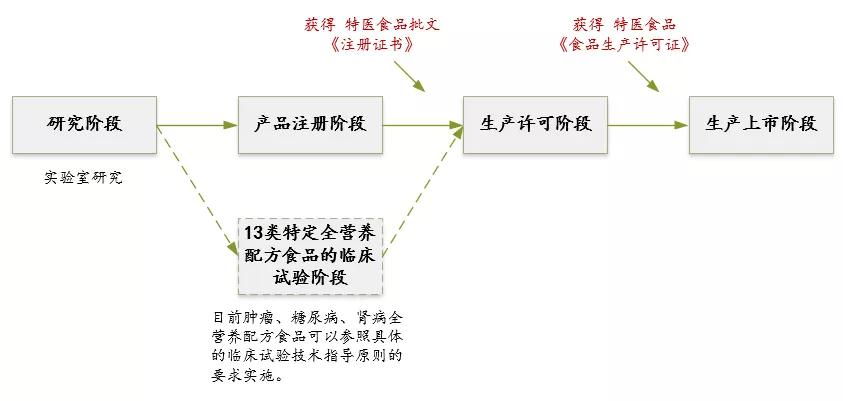
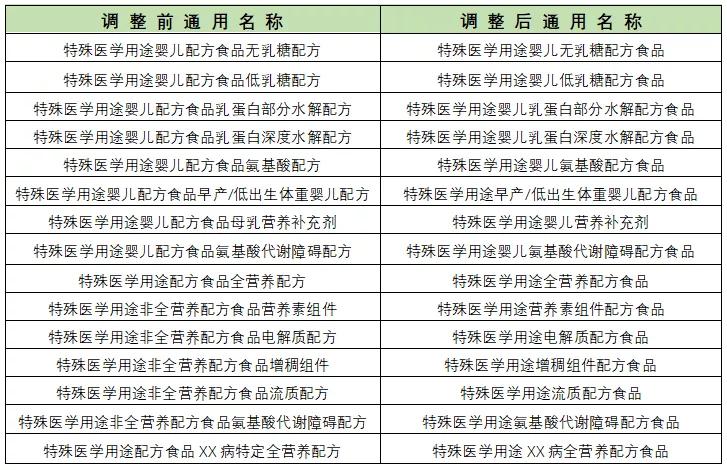
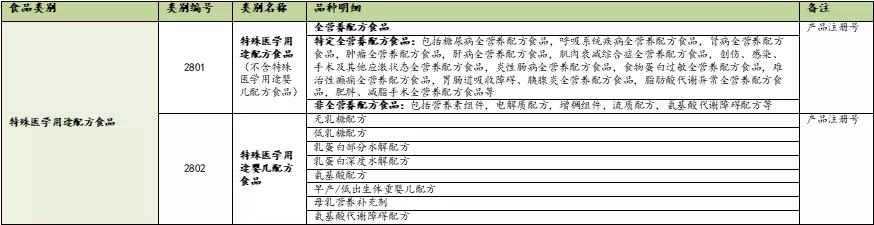
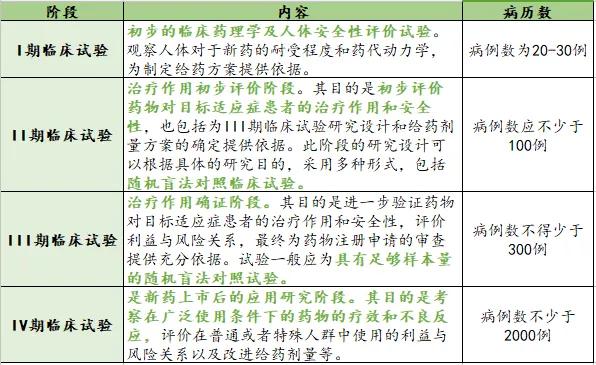
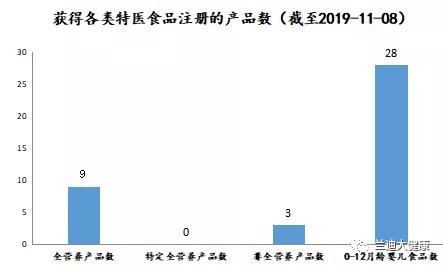
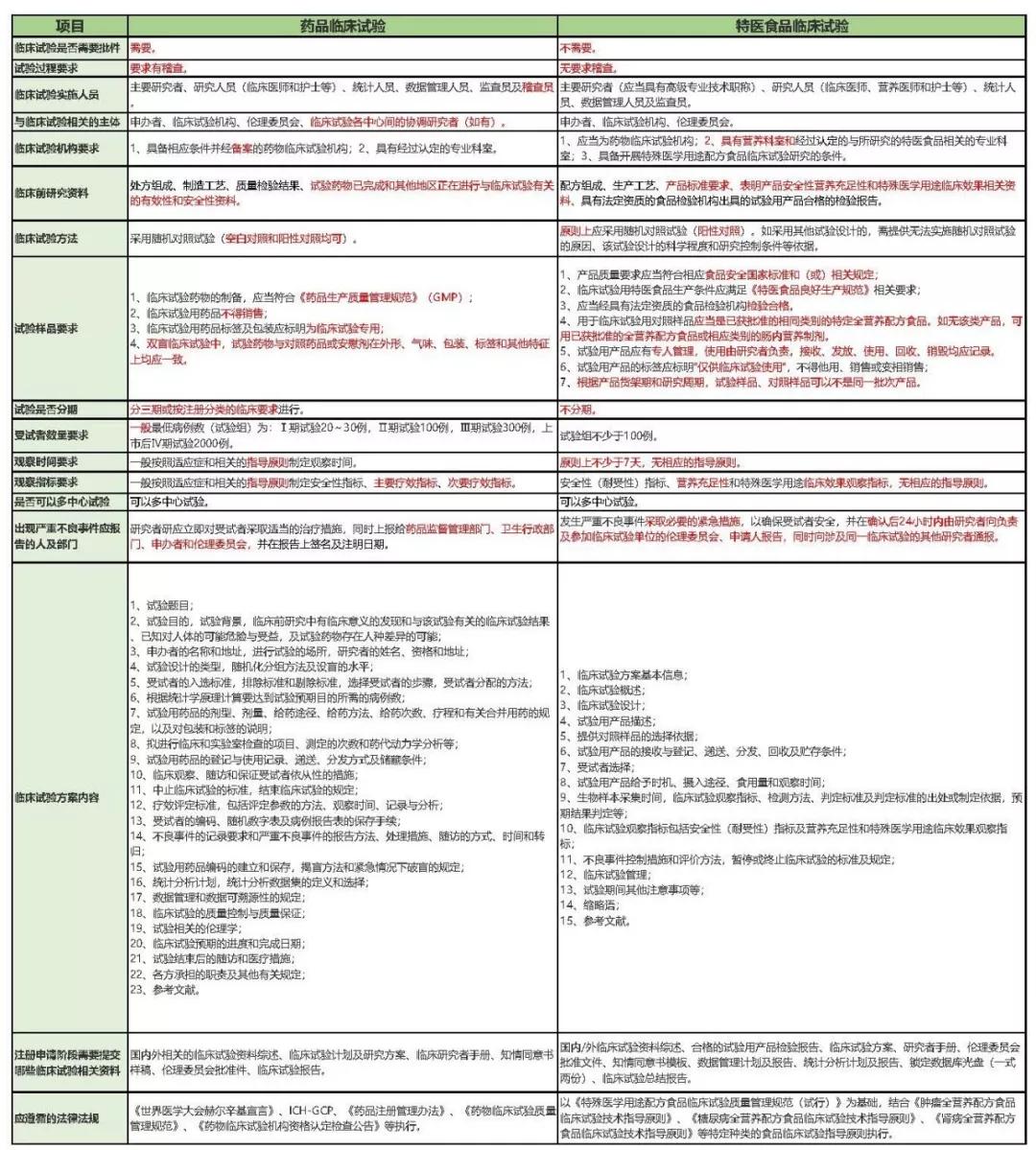
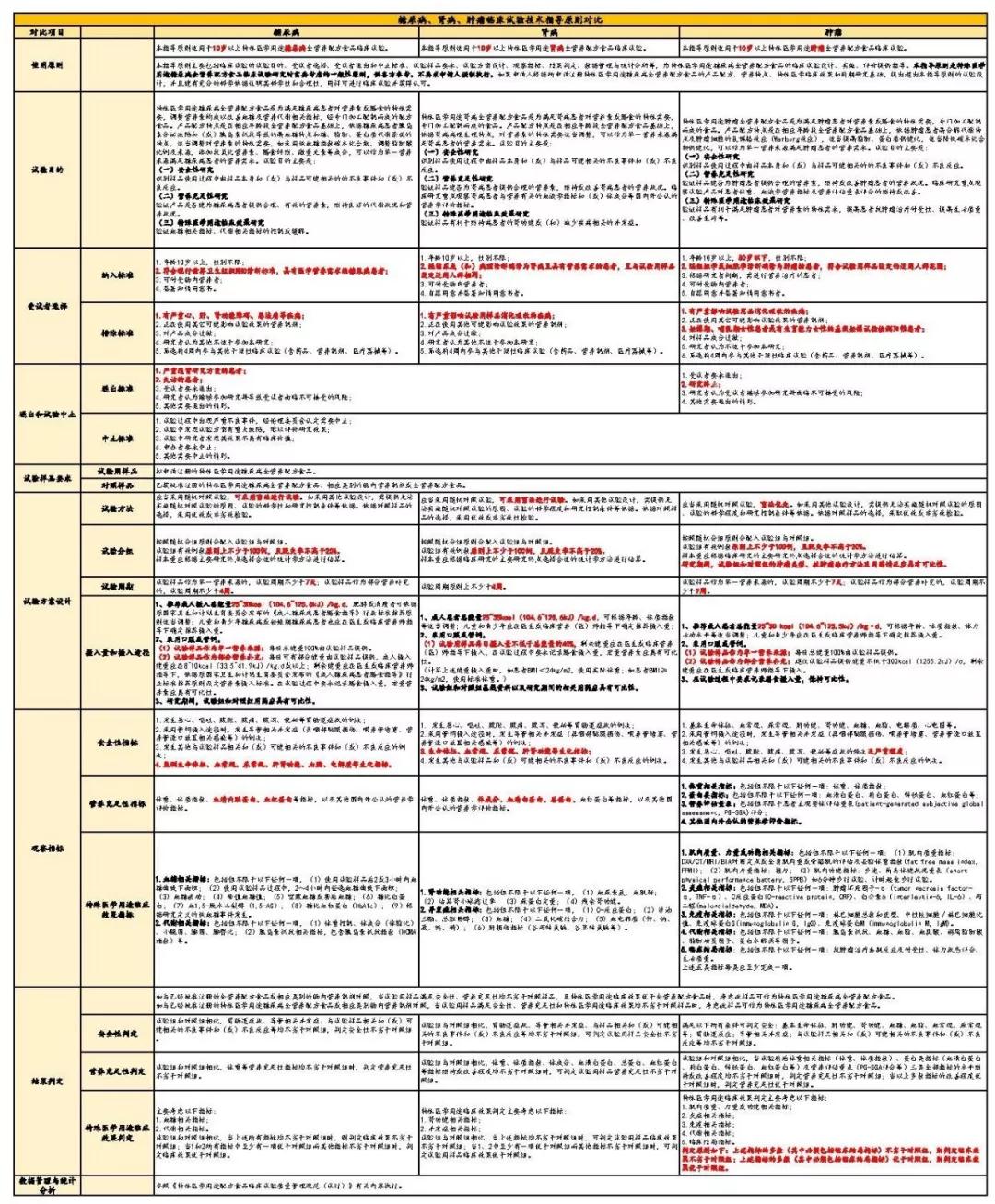
另外,在生产许可方面,即将于2019年12月1日实施的《药品管理法》第四章药品生产第四十三条规定:“从事药品生产活动,应当遵守药品生产质量管理规范,建立健全药品生产质量管理体系,保证药品生产全过程持续符合法定要求。”即不再要求进行GMP生产许可认证,但强调事中事后监管,即从事生产活动需符合GMP生产许可要求。 2、特医食品研制与生产的流程 特医食品从研发到生产的过程如下图所示。 首先,生产企业进行产品的研发,即实验室初步的研究阶段。其次,进入产品的注册阶段,由于特医食品中仅有13款针对特定疾病的特定全营养配方食品需要进行临床试验,而全营养配方食品和非全营养配方食品无需进行临床试验。产品注册通过后,获得特医食品注册证书及相应的“国食注字TY+年份+流水号”产品批准文号即产品注册成功。接着进入生产许可阶段,特医食品生产企业需要获得与具体产品相配套的《食品生产许可证》,至此即持证企业即可生产相应的特医食品。 二、注册环节的比较 1、药品注册和应遵循的规定 药品注册,指国家药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售的药品的安全性、有效性、质量可控性等进行系统评价,并决定是否同意其上市申请的审批过程。 药品注册主要遵循《药品管理法》及《药品管理法实施条例》等主要的药品管理法律法规,具体的上市注册申请,国家药品监督管理局现主要依照2007年的《药品注册管理办法》以及《总局关于发布化学药品注册分类改革工作方案的公告》(2016年第51号)等注册相关文件执行。 目前按照现行有效的2007年《药品注册管理办法》,药品注册时将药品分为新药(包括创新药和改良型新药)、仿制药和进口药品,以及注册程序中涉及到的补充申请和再注册申请。结合《总局关于发布化学药品注册分类改革工作方案的公告》(2016年第51号),药品注册分类如下图。 另外,随着药品管理法的修订,相关的配套法规正在陆续完善。2019年10月15日《药品注册管理办法》征求意见稿已发布,可看出将药品注册事项暂定为同《药品管理法》一致的中药、化学药和生物制品三大类。 药品注册申请人应当符合下列条件: 根据新《药品管理法》第三十条规定:“药品上市许可持有人是指取得药品注册证书的企业或者药品研制机构等。”同时《药品注册管理办法》(征求意见稿)第十条也规定:“申请人应当为能够承担相应法律责任的企业或者药品研制机构等。” 综上,新法排除了个人成为持有人的情形。国家药品监督管理局局长焦红在试点实施情况报告中表示,科研人员以自然人形式作为药品上市许可持有人存在难以在商品交易、纳税等多个方面正常开展市场经营活动;缺乏专业团队支持,不能对药品研发、生产、流通等环节实施有效管理;往往缺乏资金支持,不具备责任承担能力无法保证药品生产销售全生命周期的质量管理责任等的局限性。 2、特医食品注册和应遵循的规定 特医食品注册,是指国家市场监督管理总局根据申请,依照本办法规定的程序和要求,对特殊医学用途配方食品的产品配方、生产工艺、标签、说明书以及产品安全性、营养充足性和特殊医学用途临床效果进行审查,并决定是否准予注册的过程。 特医食品注册主要遵循《特殊医学用途配方食品注册管理办法》及其四个附件规定:《特殊医学用途配方食品标签、说明书样稿要求(试行)》、《特殊医学用途配方食品稳定性研究要求(试行)》、《特殊医学用途配方食品注册申请材料项目与要求(试行)》以及《特殊医学用途配方食品注册现场核查工作实施规范》。 根据国家市场监督管理局2019年5月28日发布的《关于调整特殊医学用途配方食品产品通用名称的公告》,特医食品注册中通用名称的拟定按照下表进行了简化调整。我们可以看出特医食品可以注册的种类如下表。 而针对《食品生产许可证》中的特医食品种类,生产许可分为两类:2801特殊医学用途配方食品和2802特殊医学用途婴儿配方食品,具体如下图。 特医食品注册申请人应当符合下列条件: (一)申请人应当是生产企业,包括拟向我国境内生产并销售特殊医学用途配方食品的生产企业和拟向我国境内出口特殊医学用途配方食品的境外生产企业(不包括个人)。 (二)申请人应当具备相应的研发能力,设立特殊医学用途配方食品研发机构并配备专职的产品研发人员,研发机构中应当有食品相关专业高级职称以上或者相当专业能力的人员。 (三)申请人应当具备相应的生产能力,配备食品安全管理人员和食品专业技术人员,执行特殊医学用途配方食品良好生产规范和食品安全管理体系。 (四)申请人应当具备按照特殊医学用途配方食品国家标准规定的全部项目逐批检验的能力。 三、临床试验环节比较 1、药品临床试验应遵循的法律法规 根据《药物临床试验质量管理规范》第六十八条规定:“临床试验(Clinical Trial),指任何在人体(病人或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性。” 将于2019年12月1日实施的《药品管理法》第十七条规定:“从事药品研制活动,应当遵守药物非临床研究质量管理规范、药物临床试验质量管理规范,保证药品研制全过程持续符合法定要求。”《药品管理法实施条例》第二十八条:“药物非临床安全性评价研究机构必须执行《药物非临床研究质量管理规范》,药物临床试验机构必须执行《药物临床试验质量管理规范》。”即临床前的研究阶段遵循《药物非临床研究质量管理规范》,临床试验阶段须遵循《药物临床试验质量管理规范》(GCP)和我国各项相关法律法规制度及作为临床试验基础的2013版《世界医学大会赫尔辛基宣言》(Helsinke宣言)、ICH-GCP等国际规范。 《药物临床试验质量管理规范》是临床试验全过程的标准规定,适用于各期临床试验、人体生物利用度或生物等效性试验,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。现行《药物临床试验质量管理规范》为2003年9月1日版。具体对于四期临床试验的规定如下表。 另外,国家药品监督管理局在2015年2月6日、2016年12月2日等发布了《药物临床试验质量管理规范》征求意见稿,在2017年参照ICH-GCP(E6R2)指导原则的内容和格式重新进行修订,新的规范正待发布。 2、特医食品临床试验应遵循的法律法规 根据《特殊医学用途配方食品临床试验质量管理规范(试行)》第五十二条:“临床试验(Clinical Trial),指任何在人体(病人或健康志愿者)进行特殊医学用途配方食品的系统性研究,以证实或揭示试验用特殊医学用途配方食品的安全性、营养充足性和特殊医学用途临床效果,目的是确定试验用特殊医学用途配方食品的营养作用与安全性。” 截至2019年11月8日,笔者结合市监总局官网数据等途径了解到现有已获得注册的40款产品,各类数量如下图,目前尚无特定全营养产品。2019年9月27日国家市场监督管理局公布了三款特定全营养配方食品临床试验规范,即《特定全营养配方食品临床试验技术指导原则 糖尿病》、《特定全营养配方食品临床试验技术指导原则 肾病》和《特定全营养配方食品临床试验技术指导原则 肿瘤》。该三个指导原则是临床试验需要考虑的一般性原则,供各方参考且不要求申请人强制执行。这使糖尿病、肾病、肿瘤特定全营养配方食品的临床试验方法上更具可操作性。 根据《药物临床试验质量管理规范》和《特殊医学用途配方食品临床试验质量管理规范(试行)》等临床试验规定,我们将药品和特医食品临床试验涉及的一些主要方面的区别进行梳理,具体如下表(点击查看大图)。 另外,为方便企业进行合规管理,根据2019年9月27日国家市场监督管理局公布的糖尿病、肾病、肿瘤三款特定全营养配方食品临床试验规范,对其内容进行了梳理比较,总结如下表(点击查看大图)。 综上,药品与特医食品的研制与生产中的不少环节中有着千丝万缕的联系。受篇幅之限,本文中仅作提要展示,欢迎广大读者与我们交流。返回搜狐,查看更多 |
【本文地址】